 Us heu preguntat alguna vegada perquè la taula periòdica té dos grups d’elements que no hi caben? Els quinze lantànids haurien d’estar tots a la casella que es troba sota de la 39, i el mateix passa amb els 15 actínids: tots ells tenen assignat el mateix lloc sota dels lantànids, com podeu veure aquí. Tots recordem la taula periòdica dels elements. Dmitri Mendeléiev la va proposar en el seu llibre Els principis de la química l’any 1868, i encara és vigent. La taula periòdica de Mendeléiev va posar ordre en la classificació dels elements bàsics que conformen els compostos químics, que havien descobert feia molt poc científics com John Dalton i Antoine Lavoisier. No deixa de ser sorprenent que mentre la física, gràcies a persones com Galileo i Newton, ja estava força consolidada durant el segle XVII, la química no va assolir la majoria d’edat fins al segle XIX. Aquí teniu per exemple la taula d’elements proposada pel mateix Dalton, l’any 1808.
Us heu preguntat alguna vegada perquè la taula periòdica té dos grups d’elements que no hi caben? Els quinze lantànids haurien d’estar tots a la casella que es troba sota de la 39, i el mateix passa amb els 15 actínids: tots ells tenen assignat el mateix lloc sota dels lantànids, com podeu veure aquí. Tots recordem la taula periòdica dels elements. Dmitri Mendeléiev la va proposar en el seu llibre Els principis de la química l’any 1868, i encara és vigent. La taula periòdica de Mendeléiev va posar ordre en la classificació dels elements bàsics que conformen els compostos químics, que havien descobert feia molt poc científics com John Dalton i Antoine Lavoisier. No deixa de ser sorprenent que mentre la física, gràcies a persones com Galileo i Newton, ja estava força consolidada durant el segle XVII, la química no va assolir la majoria d’edat fins al segle XIX. Aquí teniu per exemple la taula d’elements proposada pel mateix Dalton, l’any 1808.
Fa poques setmanes, un grup de científics alemanys ha confirmat el descobriment de l’element 117 de la taula periòdica, tot reafirmant el que ja havia dit un grup de científics russos l’any 2010. A falta de nom definitiu, l’element 117 per ara es diu Unumseptium o eca-astatina. El descobriment té una especial importància, perquè completa la taula periòdica (el darrer element, el 118, ja havia estat descobert i ara només quedava el forat del 117 per omplir). La taula periòdica té denominació d’origen. La va proposar Mendeléiev l’any 1868 i l’ha completat l’any 2010 en Yu Organesisan i el seu grup de recerca de l’institut Dubna de Rússia.
La taula periòdica, com podem veure, és una taula de 18 columnes. Encara que la primera fila només té dos elements i a les dos següents hi ha un tros buit, la seva part inferior ocupa les 18 columnes. L’interessant de tot plegat és que, quan hi escrivim els elements ordenats segons el seu nombre atòmic, podem veure que els elements que queden a la mateixa columna tenen propietats químiques molt similars. Hi ha columnes de metalls, columnes de gasos nobles, la columna de la família del carboni i silici, la dels halògens, la dels alcalins, etcètera.
Però, a mesura que volem entendre més els fenòmens, sovint ans adonem que no tot és tan senzill com sembla. Sabeu perquè el color de l’or és tan diferent del de la plata, tot i que són a la mateixa columna de la taula periòdica? Els elements més pesats i amb major nombre atòmic de la part inferior de la taula, com és el cas de l’or, tenen un nucli atòmic amb forta càrrega elèctrica. Encara que els seus electrons, que es mouen en diferents capes, no podem saber on són, la física quàntica ens permet saber en quines regions és probable que els puguem trobar i en quines no. Aquestes regions s’anomenen orbitals. Els electrons de la capa més propera al nucli tenen un orbital de tipus S (vegeu la imatge de dalt, que podeu també veure en aquest document). Sabem ben posa cosa d’ells: només sabem que és probable que els trobem en l’esfera S. Els de la segona capa ja els podem localitzar una mica més, perquè els orbitals corresponents, de tipus P tenen la forma de dues esferes. Els orbitals de les següents capes d’electrons tenen les formes anomenades D i F tal com podeu veure a la imatge. Les propietats físiques i químiques dels elements són conseqüència de l’estructura del seu orbital extern, que és el que conté els electrons més lliures que poden interaccionar amb els d’altres àtoms per a formar molècules. Doncs bé, com que el nucli de l’àtom d’or és més pesat que el de la plata, la velocitat dels electrons del seu orbital S més intern és molt més gran i arriba a nivells relativistes, propers a la velocitat de la llum. L’efecte relativista fa que els orbitals S i P es contraguin i es facin més estables, actuant com a pantalla i deixant més lliures els electrons de l’orbital extern de tipus D. La consequència de tot plegat és que l’or absorbeix els fotons blaus de la llum blanca més que la plata, i retorna els fotons que li donen aparença daurada. Mira per on, qui ens explica el color de l’or és Albert Einstein.
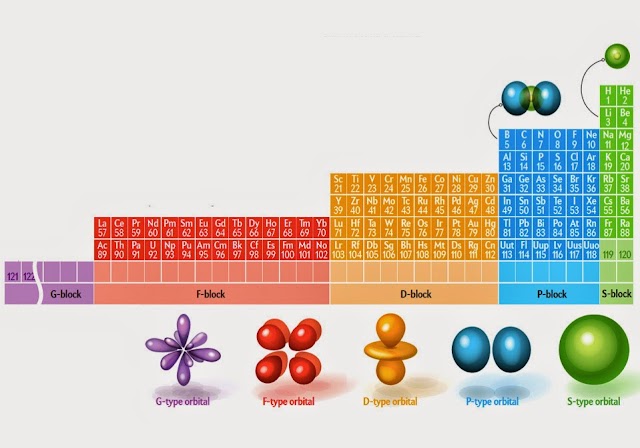
Hi ha alternatives a la taula de Mendeléiev que expliquen millor el comportament dels elements químics. L’any 1928, Charles Janet va proposar la taula periòdica que teniu a la imatge de dalt. La taula periòdica de Mendeléiev ha de tenir espais buits a les primeres files i d’altra banda no hi caben els actínids i els lantànids. Però Charles Janet es va adonar que tots aquests elements quedaven ben ordenats si s’escrivien esglaonadament. En parla en Eric Scerri en un article de fa pocs mesos a la revista Nature. Aquí teniu el document de l’article. Una bona taula periòdica ha de poder mostrar-nos les diferències d’orbitals que acabem observant en forma de propietats físiques i químiques. Als humans ens agraden les taules perquè són entenedores, però l’ordre de la natura no sempre es pot encotillar en taules rectangulars. Sabem que les propietats dels elements depenen de l’estructura dels seus orbitals més externs, i que la física quàntica ens diu el nombre de configuracions diferents que podem tenir per a cada tipus d’orbital. La conseqüència és que la taula ha de ser forçosament esglaonada, amb esglaons de mides que depenen del nombre de possibles configuracions diferents dels orbitals. Si es fa així, tal com va proposar Charles Janet, desapareixen els espais buits de les primeres files de la taula periòdica de Mendeléiev i automàticament hi caben els lantànids i actínids. Tot quadra. No hem de deixar grups d’elements a peu de pàgina de la taula.
Fixeu-vos en els esglaons de la taula de Charles Janet de la imatge. L’amplada de l’esglaó de dalt de tot (que ocupa dues files) és de 2. La del segon esglaó és 8, on 8=2+6. El tercer esglaó, que ocupa les files 5 i 6, té 18 columnes, justament l’amplada de la taula periòdica de Mendeléiev, on resulta que 18=2+6+10. L’amplada del quart esglaó és de 32, on 32=2+6+10+14. Quan es descobreixin els elements 119 i 120 ja tindrem completada tota la darrera fila de la taula esglaonada actual de Charles Janet, però encara podrem continuar perquè els següents elements, els 121 i 122, inauguraran un nou esglaó: l’esglaó dels elements amb un orbital extern de tipus G. Quants elements podem sintetitzar (si som capaços de fer-ho) en aquest nou esglaó? La resposta és immediata, perquè tot depèn d’una ben senzilla seqüència de nombres. L’esglaó dels elements amb orbitals de tipus G ocuparà dues files de la taula amb 50 elements en cada una d’elles, perquè 50=2+6+10+14+18. Els elements de la natura no es poden organitzar en una taula rectangular, però sí en una escala. I la clau de tot plegat és en la seqüència quàntica 2, 6, 10, 14, 18. Ben senzill, oi? Comenceu pel 2, aneu sumant de 4 en 4, i tindreu els esglaons de l’estructura de la matèria de tot l’Univers.
Per cert, en Vicens Navarro diu que la renda del 20% de famílies amb més ingressos de Catalunya és gairebé sis vegades superior a la renda del 20% inferior, i que aquest increment de les desigualtats ha estat més gran a Catalunya que a Espanya.
